O 19, 20 e 21 de novembro celebrouse en Sarria (Lugo) o XVIII congreso da ENCIGA (Ensinantes de Ciencias de Galicia).
O Departamento de Bioloxía presentou o proxecto educativo "Estudo xenético e ecolóxico do caracol Cepaea nemoralis (L).
Neste enlace poderás descargar o Programa e libro guía do congreso.
22 Nov 2015
25 Jul 2015
Eclosiona a segunda posta
Hoxe, 24/07/2015 eclosionaron os ovos dunha segunda posta dos caracois reclutados para estudar a súa descendencia.
Coma nos outros casos, o proxenitor trátase dun caracol de fenotipo amarelo con múltiples bandas, como podes ver nas seguintes fotografías.
Coma nos outros casos, o proxenitor trátase dun caracol de fenotipo amarelo con múltiples bandas, como podes ver nas seguintes fotografías.
21 Jul 2015
Emerxen os primeiros alevíns
Un mes e medio (44 días) despois (12/06/2015) de observar o caracol soterrado poñendo ovos (29/04/2015), eclosionan e emerxen os alevíns. Estes pequenos caracois pasarémolos a outro recipiente e alimentarémolos coa mesma pasta alimenticia a fin de que medren e poidamos observar os seus fenotipos. De momento non se poden apreciar diferencias fenotípicas entre eles.
8 May 2015
Cultivo de caracois no laboratorio para análises xenéticas
Os caracois C. nemoralis son hermafroditas. A miúdo, os arganismos que atopamos na natureza xa foron fertilizados con anterioridade polo que facer cruces selectivos no laboratorio, esixe a obtención de individuos xuvenís inmaduros.
Sen embargo, podemos analizar a descendencia dos individuos dobre homozigotos recesivos, é dicir, dos caracois amarelos de 5 bandas. Observando a descendencia destes indivíduos poderase deducir o fenotipo do outro proxenitor, do mesmo xeito que se fai nun retrocruzamento.
Con este obxectivo, a partir dos caracois atopados na natureza, seleccionáronse 5 individuos amarelos de 5 bandas para manter no laboratorio e obter a súa descendencia.
Para cultivar estes caracois no laboratorio empregáronse vasos de plástico perforados para facilitar a ventilación. Nestes vasos púxéronse 5 cm de terra (turba). a alimentación fíxose con pasta alimenticia para caracois. En todo momento mantívose un ambiente húmido e a limpeza dos recipientes fíxose semanalmente.
Sen embargo, podemos analizar a descendencia dos individuos dobre homozigotos recesivos, é dicir, dos caracois amarelos de 5 bandas. Observando a descendencia destes indivíduos poderase deducir o fenotipo do outro proxenitor, do mesmo xeito que se fai nun retrocruzamento.
Con este obxectivo, a partir dos caracois atopados na natureza, seleccionáronse 5 individuos amarelos de 5 bandas para manter no laboratorio e obter a súa descendencia.
Para cultivar estes caracois no laboratorio empregáronse vasos de plástico perforados para facilitar a ventilación. Nestes vasos púxéronse 5 cm de terra (turba). a alimentación fíxose con pasta alimenticia para caracois. En todo momento mantívose un ambiente húmido e a limpeza dos recipientes fíxose semanalmente.
Para realizar a posta de ovos, os caracois entérranse para depósitar entre 30 e 80 ovos, dos que en aproximadamente 15-20 días nacerán os alevíns.
Caracol alimentándose
Mostraxe dunha poboación
O 15 de abril de 2015 alumnos e alumnas de 4º ESO realizaron unha mostraxe dunha poboación natural de C. nemoralis, ó lado do instituto.
Os resultados da mostraxe amósanse na seguinte táboa.
|
|
Marrón
|
Rosa
|
Amarelo
|
|||
|
Bandeado
|
Nº
|
%
|
Nº
|
%
|
Nº
|
%
|
|
00000
|
0
|
0
|
1
|
4,76
|
0
|
0
|
|
00300
|
0
|
0
|
1
|
4,76
|
1
|
4,76
|
|
Múltiples bandas
|
0
|
0
|
8
|
38,10
|
10
|
47,62
|
|
TOTAL:
|
21
|
|||||
Describindo a especie
Descripción física
Cepaea
nemoralis
(L) é un caracol terrestre cun elevado polimorfismo, presentando variación na
cor da cuncha e no patrón de bandeado. A cor da cuncha varía entre marrón, rosa
e amarelo, onde as cores escuras dominan sobre as claras. O patrón de bandeado
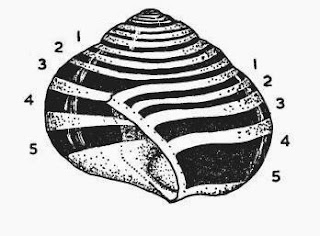
presenta cinco bandas lonxitudinais pigmentadas de marrón escuro. As bandas
numéranse empezando pola que está máis alta na espiral cara á que está máis
abaixo (figura 1). Estas bandas poden verse reducidas a 1, 2, 3, 4 ou
completamente. A ausencia de bandas é dominante sobre a presenza das mesmas,
polo que este xene é epistático sobre todos os outros que afectan ó bandeado.
Figura 1. Método de numeración de
bandas. Á dereita as bandas 4 e 5 están fusionadas (Clarke. 1960).
Nomenclatura dos fenotipos.
En primeiro lugar indícase a cor da cuncha empregando Y
(Yelow) para amarelo, P (Pink) para rosa e B (Brown) para marrón. Polo xeral o
bandeado completo consta de 5 bandas e cando falta algunha indícase mediante un
0. Se aparecen bandas fusionadas indícanse entre paréntese. Así un caracol
amarelo de 5 bandas denomínase: Y12345 (ver figura 2).
Figura 2. Fenotipos de Cepaea
nemoralis (Ozgo,
2012)
Caracteres xenéticos e modo de
herdanza
A cor e o bandeado da cuncha son exemplos de herdanza
mendeliana. Así, a seguinte táboa recolle o modo de herdanza destes caracteres.
|
13 Apr 2015
Identificación do sexo de salmón mediante PCR e illamento de plásmidos
IDENTIFICACIÓN DO SEXO DE SALMÓN MEDIANTE PCR.
Os salmóns posúen unha determinación cromosómica do sexo, de xeito similar ós seres humanos. Os machos son XY (sexo heterogamético) e as femias son XX (sexo homogamético).
A identificación do sexo dos salmóns pescados na natureza é importante xa que ó longo de toda a tempada de pesca existen diferenzas entre a proporción de femias e machos pescados ó longo da tempada. Así, ó principio da tempada péscanse principalmente femias e conforme avanza a tempada de pesca vai incrementado a proporción de machos pescados.
Se se pesca en exceso a principio da tempada córrese o risco de diminuir drásticamente a poboación de femias, desequilibrando a poboación e perxudicando á capacidade reproductiva da mesma.
A simple vista os salmóns non poden diferenciarse por sexo, tan só a final do seu ciclo reproductivo é posible diferencialos pola súa morfoloxía. Por esta razón, unha metodoloxía para identificar o sexo baséase na detección dunha secuencia de ADN do cromosoma Y.
A PCR (Reacción en Cadea da Polimerasa) é unha metodoloxía que permite amplificar unha secuencia concreta de ADN, do cromosoma Y, por exemplo. Deste xeito se o animal analizado é unha femia, as súas células terán dous cromosomas X (XX) e polo tanto a PCR non identificará ningunha secuencia de ADN propia do cromosoma Y. Polo contrario, se o individuo analizado é un macho a PCR detectará a secuencia de ADN propia do cromosoma Y e veremos un sinal positivo.
Para realizar a reacción de PCR necesitamos os seguintes compoñentes:
ADN da mostra, ADN polimerasa, nucleótidos de Adenina, de Timina, de Citosina e de Guanina, cebadores (directo e inverso), cloruro de magnesio e un tampón para manter estable o pH do medio de reacción.
Os salmóns posúen unha determinación cromosómica do sexo, de xeito similar ós seres humanos. Os machos son XY (sexo heterogamético) e as femias son XX (sexo homogamético).
A identificación do sexo dos salmóns pescados na natureza é importante xa que ó longo de toda a tempada de pesca existen diferenzas entre a proporción de femias e machos pescados ó longo da tempada. Así, ó principio da tempada péscanse principalmente femias e conforme avanza a tempada de pesca vai incrementado a proporción de machos pescados.
Se se pesca en exceso a principio da tempada córrese o risco de diminuir drásticamente a poboación de femias, desequilibrando a poboación e perxudicando á capacidade reproductiva da mesma.
A simple vista os salmóns non poden diferenciarse por sexo, tan só a final do seu ciclo reproductivo é posible diferencialos pola súa morfoloxía. Por esta razón, unha metodoloxía para identificar o sexo baséase na detección dunha secuencia de ADN do cromosoma Y.
A PCR (Reacción en Cadea da Polimerasa) é unha metodoloxía que permite amplificar unha secuencia concreta de ADN, do cromosoma Y, por exemplo. Deste xeito se o animal analizado é unha femia, as súas células terán dous cromosomas X (XX) e polo tanto a PCR non identificará ningunha secuencia de ADN propia do cromosoma Y. Polo contrario, se o individuo analizado é un macho a PCR detectará a secuencia de ADN propia do cromosoma Y e veremos un sinal positivo.
Para realizar a reacción de PCR necesitamos os seguintes compoñentes:
ADN da mostra, ADN polimerasa, nucleótidos de Adenina, de Timina, de Citosina e de Guanina, cebadores (directo e inverso), cloruro de magnesio e un tampón para manter estable o pH do medio de reacción.
Unha vez realizadas as mezclas de reacción, estas lévanse a un termociclador para sometelas a sucesivos ciclos de desnaturalización do ADN, hibridación dos cenadores e alongamento do ADN.
Unha vez rematado o proceso de amplificación do ADN, realízase unha electroforese de ADN. A electroforese é un método que permite separar moléculas de ADN polo seu tamaño, sometidos a un campo eléctrico.
Ó rematar a electroforese o ADN tínguese con bromuro de etidio. As mostras positivas (machos) presentan unha banda de cor laranxa.
EXTRACCIÓN DE PLÁSMIDOS DUN CULTIVO BACTERIANO.
Existen kits comerciais que permite, a partir dun cultivo bacteriano extraer o ADN dos plásmidos.
Os plásmidos son moléculas de ADN circular de pequeno tamaño, extracromosómico. As bacterias empregan os plásmidos para intercambiar ADN nun fenómeno coñecido como conxugación bacteriana.
Estes plásmidos son ferramentas moi útiles na clonación molecualr de xenes.
Agradecémoslle á Dra. Paloma Morán polo seu apoio na realización desta actividade e a Borja polo súa axuda.
Subscribe to:
Posts (Atom)